近日,太阳集团tcy8722网站魏金红副教授与加拿大卡尔加里大学S.R.WayneChen教授在国际心血管领域顶级期刊CirculationResearch(IF=23.213)在线发表了题为“RyR2Serine-2030PKASiteGovernsCa2+ReleaseTerminationandCa2+Alternans”的研究论文,该研究运用基因突变动物与分子细胞手段,阐明了RyR2钙释放终止的PKA调节机制。同时,该研究发现PKA依赖的RyR2S2030磷酸化位点是心脏Ca2+释放终止和Ca2+瞬变交替的主要决定因素。此项研究有助于揭示引起心律失常等心脏疾病发生机制,并为开发新型干预方法提供理论基础。
太阳集团tcy8722网站魏金红副教授为第一作者兼共同通讯作者,太阳集团tcy8722网站为本文的第一作者单位。加拿大卡尔加里大学S.R.WayneChen教授为共同通讯作者。本工作获得了国家自然科学基金面上项目(No.82270323)的支持。魏金红副教授电子邮箱:jinhong.wei@nwu.edu.cn
论文链接:https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.122.321177
研究简介:
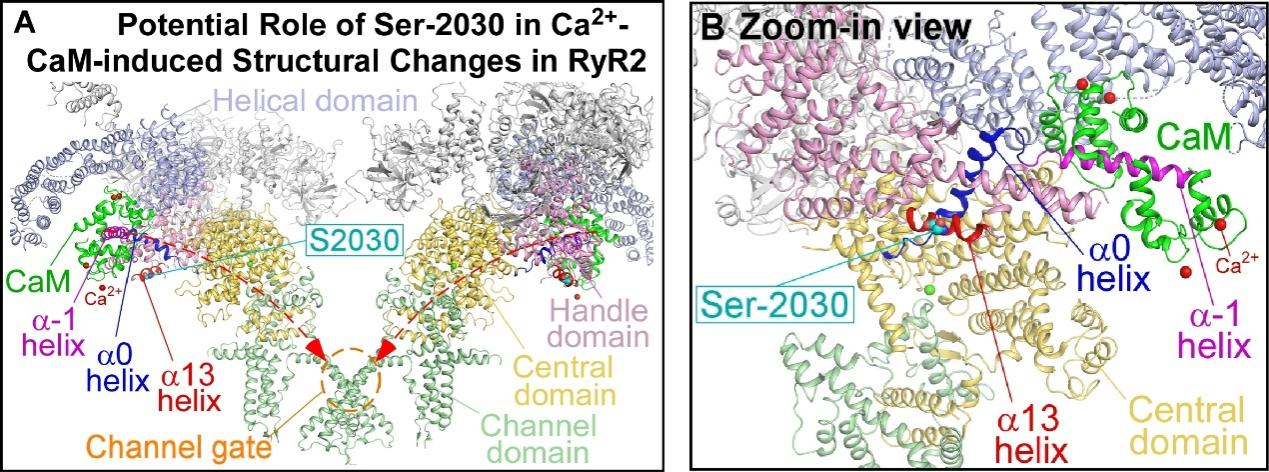
蛋白激酶A(PKA)介导的心脏兰尼碱受体(RyR2)磷酸化已被广泛研究数十年,但目前对RyR2的PKA磷酸化的生理学意义仍知之甚少。魏金红副教授基于前期对钙调蛋白(CaM)复合的RyR2高分辨率三维结构的测定,发现RyR2的主要PKA磷酸化位点丝氨酸2030(S2030)位于RyR2的CaM依赖性失活的结构途径中(图A,B)。这种新颖的结构提示了RyR2的PKA磷酸化在CaM依赖性RyR2失活中可能发挥的重要作用
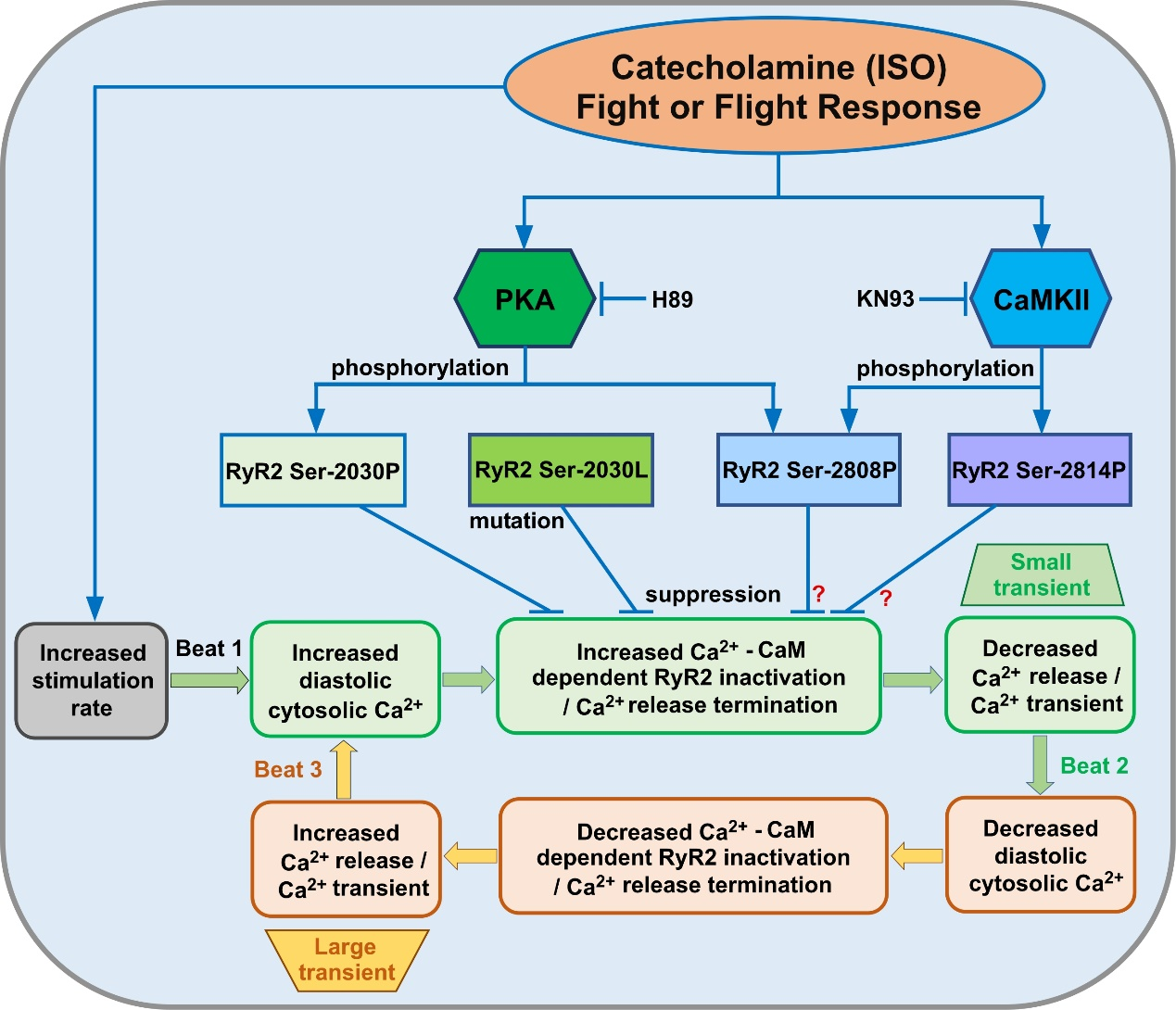
魏金红副教授及其研究团队使用单细胞内质网Ca2+成像技术,系统评估了S2030突变对HEK293细胞Ca2+释放终止的影响,并发现了S2030L突变消除了CaM-WT、CaM-M和PKA在Ca2+释放终止中的作用,但没有改变CaMKII的作用。为确定PKA位点RyR2-S2030在生理环境中的作用,研究团队建立了一种带有S2030L突变的新型小鼠模型。通过使用共聚焦Ca2+成像,发现了:异丙肾上腺素和CaM-M抑制起搏诱导的Ca2+瞬变交替并加速心脏Ca2+的瞬时恢复能力,而CaM-W则发挥相反作用;异丙肾上腺素的影响分别被PKA抑制剂H89部分逆转,被CaMKII抑制剂KN93完全逆转;S2030L消除了异丙肾上腺素的CaM-WT、CaM-M和H89依赖性影响,但没有消除KN93的影响。
该研究首次证明PKA磷酸化位点RyR2-S2030是由PKA调节,并且也是CaM依赖性Ca2+释放终止和Ca2+瞬变交替的重要决定因素。魏金红副教授的该研究结果开辟了以肌浆网钙释放终止阈为切入点调控RyR2磷酸化的全新途径,使其向临床应用迈进了关键一步。
魏金红副教授及其团队简介:
近年来,魏金红副教授与加拿大卡尔加里大学S.R.WayneChen教授合作,在心脏钙调控、心律失常及心源性猝死等生命健康领域取得一系列重要成果。
2019年,该团队从结构到功能系统揭示了钙调蛋白对心脏兰尼碱受体的调控机制,为RyR2调控的基础研究、临床心脏学的心律调节和异常诊治开拓了新的研究领域;
2021年,该团队建立了研究Ca2+释放终止的平台和最先进的原位完整心脏Ca2+成像技术,应用先进的腺病毒载体精准治疗手段,首次揭示RyR2的Ca2+-CaM依赖性失活是心脏钙瞬变交替的主要决定因素,解开了钙瞬变交替发生机制150年的谜团。该团队还利用基因突变动物与分子细胞手段,在国际上首次揭示RyR2的PKA磷酸化导致钙释放终止阈变化的新分子机制,为从肌浆网钙释放终止阈为切入点开发干预心律失常提供创新方法;
2022年,该团队与多国多中心合作,首次定义钙释放缺乏综合症(CRDS),并揭示相关RyR2突变体的临床和功能表征,具有开创性,被领域内认定为与CPVT、LQTS等并列的遗传性心律失常新亚型。
这一系列研究成果,魏金红副教授以第一或通讯作者身份先后发表在Nature(2019),CirculationResearch(2021,2023),JAMACardiology(2022)等国际顶级期刊。